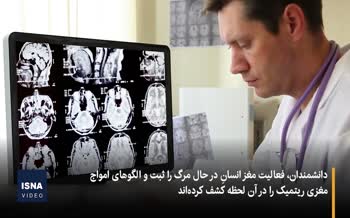
پژوهشگران برای نخستین بار مشاهده کردند که سلول های سرطانی چگونه قادر به مقاومت دربرابر شیمی درمانی طراحی شده برای توقف تقسیم سلولی می شوند.
به گزارش ایسنا به نقل از نیو اطلس، محققان برای نخستین بار مکانیسمی را مشاهده کردند که توسط سلول های سرطانی برای مقاومت در برابر اثرات شیمی درمانی استفاده می شود. یافته های این مطالعه می تواند برای تولید داروهای هدفمند برای کمک به غلبه بر این مشکل و موثرتر کردن شیمی درمانی استفاده شود.
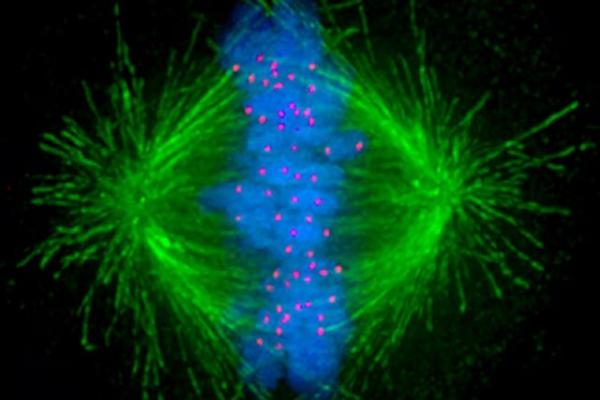
وقتی سلول ها تقسیم می شوند ، ساختارهای ریز لوله مانندی درون سلول به نام میکروتوبول ها (microtubules) مانند بازوهای مکانیکی عمل می کنند و مواد ژنتیکی را جدا می کنند و تولید موفقیت آمیز سلول های دختر را تضمین می کنند.
تقسیم سلولی یا تقسیم یاخته ای فرآیندی است که در آن یک سلول مادر به دو یا چند سلول دیگر (سلول های دختر) تقسیم می شود.
با توجه به افزایش سرعت تقسیم سلول های سرطانی در مقایسه با سلول های طبیعی، داروهای شیمی درمانی ضد میکروتوبول این ساختارها را هدف قرار میدهند تا از رشد سرطان جلوگیری کنند. ولی سلول های سرطانی حیله گر هستند و راه هایی برای اطمینان از اینکه درمان همیشه مؤثر نباشد، ایجاد می کنند.
اکنون، برای نخستین بار پژوهشگران دانشگاه نیو ساوث ولز (UNSW) در سیدنی استرالیا مکانیسمی را مشاهده کرده اند که سلول های سرطانی از آن برای مقاومت دربرابر اثرات کیموتراپی (chemotherapy) استفاده می کنند.
پیتر گانینگ، نویسنده مسوول این مطالعه گفت: شیمی درمانی ضد میکروتوبول معمولاً این بازوهای مکانیکی را به هاب های متعددی قسمت میکند که کروموزوم ها را به جای دو جهت عادی به چند جهت می کشند. هرج و مرج حاصل از جداسازی مناسب کروموزوم ها به دو سلول دختر جلوگیری می کند و باعث آپوپتوز یا مرگ برنامه ریزی شده سلولی می شود.
پژوهشگران دریافتند که سلول های سرطانی از یک روش بسیار زیرکانه استفاده می کنند که به آنها اجازه می دهد به تقسیم خود ادامه دهند و در نتیجه از اثراتی که شیمی درمانی برای القای آن طراحی شده است، جلوگیری می کند.
گانینگ می گوید: ما کشف کردیم که سلول های سرطانی از نیروی مکانیکی تامین شده توسط لبه سلول به نام قشر سلول برای غلبه بر تاثیر شیمی درمانی استفاده می کنند که توانایی سلول را برای جداسازی کروموزوم ها در طول تقسیم سلولی مسدود می کند.
سلول های سرطانی هنگامی که میکروتوبول ها باعث می شوند بازوها به سمت لبه سلول دراز شوند و قشر را بکشند تا قطعات را به هم برگردانند، یک سیگنال را فعال می کنند.
گانینگ می گوید: این به بازوها اجازه می دهد تا تثبیت شوند و نیروی لازم برای گرفتن و کشیدن کروموزوم ها به داخل هر سلول دختر و اطمینان از تکثیر سلول های سرطانی را ایجاد کنند.
پژوهشگران پس از مشاهده یک داروی خاص برای هدف گیری میکروتوبول که برای درمان نوروبلاستوما - سرطان دوران کودکی- استفاده می شود، مشکوک شدند که این مکانیسم وجود دارد، چراکه اثرات شیمی درمانی را افزایش داد. اما در زمان مطالعه قبلی آنها، روش تصویربرداری به اندازه کافی برای تأیید ظن آن ها پیشرفته نبود.
گانینگ می گوید: ما نیاز به تصویربرداری خوب از سلول های سرطانی در حین تقسیم سلولی داشتیم تا آنچه را که برای کروموزوم ها، میکروتوبول ها و معماری سلول ها در لحظه اتفاق می افتد، به تصویر بکشیم.
او ادامه داد: کشف این موضوع برای ما کاملاً تعجب آور بود، زیرا انتظار نداشتیم این مکانیسم سلول سرطانی به این شکل برای غلبه بر درمان سرطان (cancer) مورد استفاده قرار گیرد، اما می توانستیم آن را جلوی چشمانمان ببینیم.
دوزهای بالای شیمی درمانی بطور کلی در جلوگیری از تقسیم سلول های سرطانی موثر است. با این حال، در دوزهای پایین تر – زمانی که مثلاً بیمار دچار سمیت شیمی درمانی می شود و دوز آن باید کاهش یابد – سلول ها می توانند از این مکانیسم بقای ذاتی استفاده کنند، چیزی که پژوهشگران فکر می کنند جزء اساسی زیست شناسی سلولی است.
گانینگ می گوید: ما فکر می کنیم این یک مکانیسم بازگشتی است که تکامل یافته است تا به هر سلولی اجازه دهد بر مقدار کمی از اختلالات میکروتوبول غلبه کند و اطمینان حاصل کند که میتواند زنده بماند و اتفاقاً سلول های سرطانی از آن برای دور زدن شیمی درمانی ضد میکروتوبول استفاده می کنند.
اکنون پژوهشگران بر روی تولید داروهایی متمرکز شده اند که در ترکیب با عوامل شیمی درمانی فعلی کار می کنند تا این مکانیسم مقاومت را متوقف کنند.
گانینگ می گوید: با حمله به ماشین های تولید نیرو که توسط سلول های سرطانی ساخته شده اند، انتظار داریم که بتوانیم به درمان سرطان اجازه دهیم کار خود را بسیار مؤثرتر انجام دهد. از نظر عملی، ما شرکتی را تاسیس کرده ایم که به ما امکان می دهد داروهای موردنیاز برای حمله به این مکانیسم نجات را توسعه دهیم و شیمی درمانی ضد میکروتوبول را قادر می سازد تا به طور مؤثرتری عمل کند و امیدواریم نتایج بیمار را بهبود بخشد.
این مطالعه در مجله Current Biology منتشر شده است.
- 14
- 3