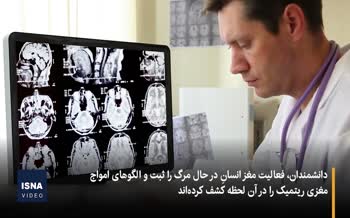
نتایج موفقیت آمیز آزمایش های فناوری" کریسپر" حاکی از این هستند که بزودی، نخستین داروی مبتنی بر این فناوری ارائه خواهد شد.
به گزارش ایسنا به نقل از فست کمپاني، تا همین اواخر، فناوری ویرایش ژن موسوم به "کریسپر" (CRISPR)، بیشتر شبیه به داستان های علمی- تخیلی بود تا پزشکی. این فناوری که شبیه به یک قیچی مولکولی ساخته شده در آزمایشگاه است، برای بریدن بخش های مشکل ساز DNA در سلول های بیمار و با هدف درمان بیماری استفاده می شود. بزودی می توانیم شاهد این موضوع باشیم که نخستین درمان با استفاده از فناوری ویرایش ژن و در تلاش برای مبارزه با اختلالات خونی نادری که میلیون ها نفر را در سراسر جهان تحت تأثیر قرار میدهند، تائید می شود.
متخصصان بیماری های نادر شرکت های آمریکایی "ورتکس" (Vertex) و "کریسپر تراپیوتیکس" (CRISPR Therapeutics) در یک همکاری ۹۰۰ میلیون دلاری، درمانی را ابداع کرده اند که "exa- cel" نام دارد. پیشتر شواهد امیدوار کننده ای جمع آوری شده اند که نشان می دهند این روش می تواند به بیماران مبتلا به تالاسمی بتا و "بیماری کم خونی داسی شکل" (SCD) کمک کند.
تالاسمی بتا با ژن های آسیب دیده یا از دست رفته همراه است که باعث میشوند تا بدن، هموگلوبین کمتری تولید کند و به بزرگ شدن کبد، طحال یا قلب و شکل گیری استخوان های ناقص یا شکننده منجر شود. تخمین زده می شود که از هر ۱۰۰ هزار نفر در جهان، یک نفر به این بیماری مبتلا شود و برای جلوگیری از جدی ترین عوارض آن، تزریق خون به صورت منظم ضروری است.
اگرچه آمار دقیق در مورد تعداد افراد مبتلا به بیماری کم خونی داسی شکل، ناشناخته است اما تخمین زده می شود که این بیماری ۱۰۰ هزار نفر را در آمریکا و میلیون ها نفر را در سراسر جهان تحت تاثیر قرار دهد. این بیماری را به یک ژن معیوب نسبت می دهند که باعث ایجاد هموگلوبین بد شکلی می شود که سفت، چسبنده و داسی شکل است؛ از این رو میتواند مانع انتقال اکسیژن به واسطه سلول های خونی سالم در بدن شود.
گزارش ها نشان می دهند که درمان Exa- cel، نیاز به انتقال خون یا بروز حوادث پزشکی جدی و تهدیدکننده زندگی را برای ماه ها تا سالها پس از دریافت درمان توسط بیماران کاهش می دهد.
نتایج جدید و چشمگیر کارآزمایی بالینی، در یک کنفرانس بزرگ و بین المللی پزشکی در ماه ژوئیه اعلام شد و چشمانداز شرکت ها را برای تولید نخستین درمان ویرایش ژن در نوع خود و همچنین، دسترسی به بازار گسترده تر و بیماران بیشتر تقویت کرد.
سازندگان exa- cel می گویند که تصمیم دارند تا پایان امسال، این دارو را برای تایید نظارتی در آمریکا، بریتانیا و اروپا ارائه کنند. این بدان معناست که exa- cel میتواند مجوز بازاریابی را در سال ۲۰۲۳ دریافت کند زیرا شرکت های دارویی بیشتر به دنبال روش های ژن درمانی (Gene Therapy) جدید هستند.
درمان ورتکس و کریسپر تراپیوتیکس، از آنچه که ژن درمانی "ex- vivo" نامیده می شود، استفاده می کند. در این روش، سلول های بنیادی بیمار استخراج می شوند؛ سپس، دی ان ای (DNA) سلول با روش exa- cel اصلاح می گردد تا تولید ژن را تحریک کند. نوعی هموگلوبین که بدن معمولا فقط در دوران نوزادی تولید می کند و سلول های اصلاح شده برای تقویت هموگلوبین سالم و تولید گلبول های قرمز خون، به بیمار بازگردانده می شود.
جدیدترین داده های بالینی exa- cel که در کنگره "انجمن هماتولوژی اروپا" (EHA) سال ۲۰۲۲ در سوئیس ارائه شد، نشان داد که همه ۷۵ بیمار مبتلا به تالاسمی بتا یا کم خونی داسی شکل که با ویرایش ژن تحت درمان قرار گرفتند، نیازی به تزریق خون نداشتند یا این که نیاز به تزریق خون یا بروز انسدادهای تهدیدکننده زندگی در آنها بسیار کاهش یافته بود. همه به غیر دو نفر از ۴۴ بیمار مبتلا به تالاسمی، طی یک تا ۳۷ ماه پیگیری پس از تجویز درمان، نیازی به تزریق خون نداشتند و نیاز به تزریق خون در دو نفر باقی مانده نیز تا ۷۵ و ۸۹ درصد کاهش یافته بود.
کریسپر، تنها نوع ژن درمانی نیست که موجی از آن ایجاد شده است. گروهی از مشاوران "سازمان غذا و داروی آمریکا" (FDA) در اوایل ماه ژوئیه، به اتفاق آرا توصیه هایی را در مورد نوعی ژن درمانی ارائه کردند که بر فناوری کریسپر مبتنی نبود و شرکت" بلوبرد بایو"( Bluebird Bio) آن را ارائه داده بود. این درمان ها، ژن های مرتبط با تالاسمی بتا و اختلال نادری به نام "آدرنولکودیستروفی مغزی" (CALD) را هدف قرار می دهند. آدرنولکودیستروفی مغزی، نوعی بیماری است که ماده سفید مغز را در کودکان از بین می برد، درمانهای کمی دارد و معمولاً طی پنج تا ۱۰ سال منجر به مرگ می شود.
روش درمانی شرکت بلوبرد بایو به دلیل ارتباط آن با افزایش خطر ابتلا به نوعی سرطان، با مشکلات بالینی مواجه شده است ولی مشاوران به این نتیجه رسیدند که مزایای آن هنوز برای برخی از بیماران، کمی بیشتر از خطرات آن است. سازمان غذا و داروی آمریکا مجبور نیست از توصیه های پنل های مشاوره خود پیروی کند اما معمولا این کار را انجام می دهد.
حدود ۲۰ نوع درمان سلولی و ژنی وجود دارد که تا به امروز تأییدیه سازمان غذا و داروی آمریکا را دریافت کرده اند؛ اگرچه هیچ کدام مبتنی بر ویرایش ژن کریسپر نیستند. برنامه توسعه دارویی موسوم به "NEWDIGS" دانشگاه "ام آی تی" (MIT) نشان می دهد که امکان دارد تا سال ۲۰۳۰، بیش از ۶۰ درمان ژنی و سلولی در بازار آمریکا وجود داشته باشد. این امر میتواند به دگرگونی نحوه تفکر ما در مورد بیماری های غیرقابل درمان بیانجامد.
کشف دارو، یک فرآیند طولانی و غیرقابل پیش بینی است ولی تاثیری که ویرایش ژن میتواند بر توسعه دارو و نحوه تفکر ما درباره بیماری داشته باشد، از قبل مشخص شده است؛ همان گونه که "جان مور" (Jon Moore)، مدیر ارشد علمی شرکت زیست فناوری "هورایزن دیسکاوری" (Horizon Discovery) در سال ۲۰۱۶ گفت: هدفی که ما با فناوری کریسپر پیدا می کنیم، قرار است به کشف داروهایی کمک کند که در سال ۲۰۲۰ ارائه می شوند.
قابلیت اولیه exa- cel تنها شش سال بعد از این حرف، نشان می دهد که این یک شرط معقول است.
- 9
- 2