انبوهی از پروتئینهای کژتابیده که در مغز جمع می شوند با بروز بیماری های عصبی مانند پارکینسون مرتبط هستند. اکنون، نانو بادی هایی که به تازگی شناسایی شده اند نویدبخش بی ثبات کردن ساختار این توده ها بوده اند و به طور بالقوه میتوانند به ایجاد درمان های جدیدی برای این بیماری کمک کنند.
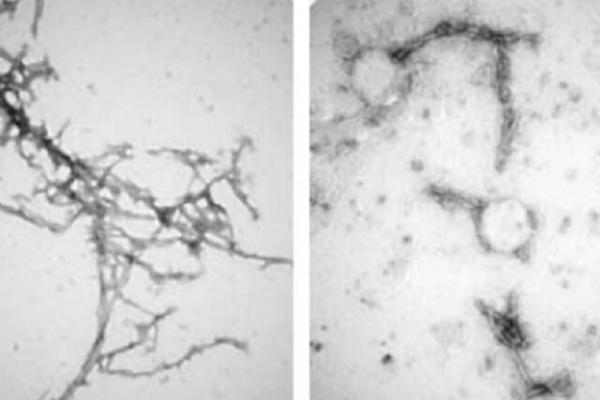
به گزارش ایسنا به نقل از نیواطلس، پروتئینی که در مرکز این مطالعه قرار دارد، آلفا سینوکلئین (alpha- synuclein) نامیده می شود. تصور می شود که این پروتئین به تنهایی نقش مهمی در فعالیت های مغز ایفا می کند، اما می تواند به طور نادرست انباشته شده و به صورت توده هایی با عنوان اجسام لوی (Lewy bodies) جمع شود. این پروتئین ها (Protein)میتوانند بر عملکرد نورون ها تأثیر بگذارند و حتی شروع به کشتن آن ها کنند و بر ایجاد اختلالات عصبی مانند بیماری پارکینسون اثر بگذارند.
بسیاری از تحقیقات در مورد بیماری پارکینسون (Parkinson's Disease) بر روی این اجسام لوی متمرکز شده است، و نشان می دهد که چگونه این توده ها می توانند پیش از رسیدن به مغز ابتدا در روده شکل بگیرند. همچنین تحقیقاتی مبنی بر خودایمنی بودن این بیماری نیز انجام شده است. محققان دیگر اجسام لوی را با آنزیم های مصنوعی یا پپتیدهای تصفیه شده هدف قرار داده اند که نتایج امیدوارکننده ای داشته است.
در این مطالعه جدید، محققان مرکز پزشکی جان هاپکینز و دانشگاه میشیگان، به بررسی استفاده از نانوبادی ها برای تجزیه اجسام لوی پرداختند. نانوبادی ها نسخه های کوچک تری از پروتئین های آنتی بادی هستند که توسط سیستم ایمنی برای ردیابی عوامل بیماری زا استفاده می شوند. اندازه کوچک تر آنها به این نانوبادی ها اجازه می دهد تا از طریق غشای پلاسمایی (Plasma membrane) های مغزی وارد شوند، و به توده های آلفا سینوکلئین متصل شده و آنها را تجزیه کنند.
به طور معمول، این نانوبادی ها در داخل سلول ها تجزیه میشوند، بنابراین محققان آن ها را طوری مهندسی کردند که فاقد پیوندهای شیمیایی خاصی باشند که در برابر این فرآیند آسیب پذیر هستند. آنها دریافتند که این کار، نانوبادی ها را بدون کاهش توانایی آنها در اتصال به توده های آلفا سینوکلئین پایدار نگه می دارد.
محققان پس از آزمایش هفت نسخه از نانوبادی ها، یکی از آن ها به نام PFFNB۲ را به عنوان بهترین کاندید شناسایی کردند. در آزمایش هایی که روی سلول های زنده مغز و بافت موش ها انجام شد، مشخص شد که نانوبادی PFFNB۲ پایدار بوده و با قدرت به توده های پروتئین متصل می شود و به طور موثر آن ها را تجزیه می کند.
رامهری کومبهار (Ramhari Kumbhar)، یکی از محققان این مطالعه می گوید: به طرز شگفت انگیزی، ما بیان PFFNB۲ را در قشر مغز ایجاد کردیم و از گسترش توده های آلفا سینوکلئین در قشر مغز موش، منطقه ای که مسئول شناخت، حرکت، شخصیت و سایر فرآیندهای مهم است، جلوگیری کردیم.
نکته حائز اهمیت این است که محققان دریافتند که نانوبادی ها فقط به توده های آلفا سینوکلئین حمله می کنند و به ملکول هایی که عملکردهای حیاتی را در سلول های مغزی برعهده دارند، در امان هستند.
شیابو مائو( Xiabo Mao)، نویسنده ارشد این مطالعه می گوید: موفقیت نانوبادی PFFNB۲ در اتصال به توده های مضر آلفا سینوکلئین در محیط های پیچیده تر نشان می دهد که این نانوبادی میتواند کلیدی برای کمک به دانشمندان در مطالعه این بیماری ها و در نهایت توسعه درمان های جدید باشد.
این مطالعه در مجله Nature Communications منتشر شده است.
- 18
- 2